Nguyên nhân gây ra bệnh ung thư là gì? Hãy hỏi những bà mẹ, người sẽ trả lời cho bạn rằng ung thư xuất phát từ việc bạn ăn đồ linh tinh ngoài đường, hay thức khuya và suốt ngày xem điện thoại.
Các bác sĩ, những người đã mất ít nhất 6 năm trong trường y, sẽ cho bạn một câu trả lời công tâm hơn: Rằng chỉ có 30-50% các ca ung thư xuất phát từ lối sống. Còn lại 40-65% số ca ung thư xảy ra là do quá trình lão hóa tự nhiên của cơ thể.
Thậm chí, có từ 5-10% số người mắc ung thư là do định mệnh đã sắp đặt. Những bệnh nhân này thừa hưởng gen di truyền gây ung thư từ cha mẹ, ông bà, ngay từ khi sinh ra. Việc họ lớn lên và mắc ung thư là điều gần như không thể tránh khỏi.
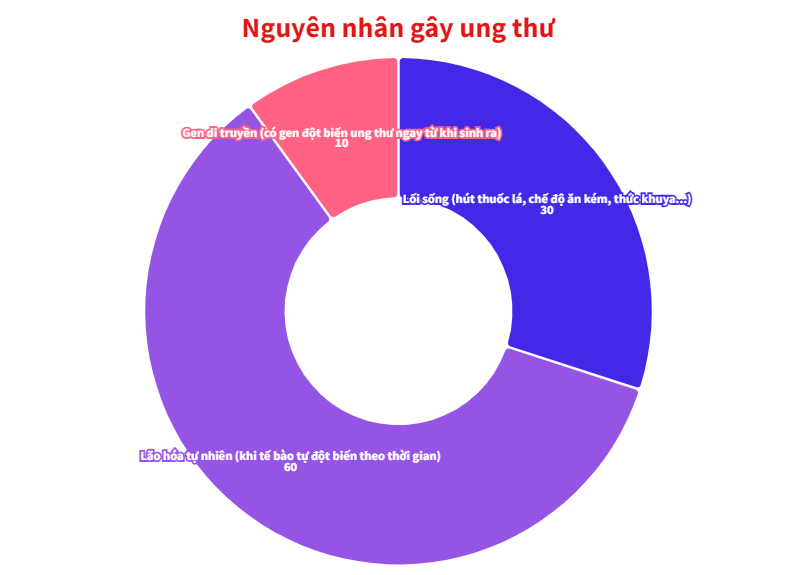
Ảnh minh họa: Genk.
Những con số chắc chắn đã giải thích cho bạn lý do tại sao nhiều người nghiện thuốc lá mà không hề mắc ung thư. Trong khi, có người cả đời không chạm vào một điếu thuốc nào, thì lại mắc ung thư phổi.
Thế nhưng, cho dù đó có là hút thuốc lá, chế độ ăn kém lành mạnh, do quá trình lão hóa tự nhiên hay ung thư đã xuất phát từ chính bộ gen của bạn, có một nút thắt chung đã khiến bệnh ung thư khởi phát: Đó là những gen bị đột biến.
Bất kỳ một người có kiến thức cơ bản nào đều biết đột biến gen là thứ đã biến một gen bình thường thành gen ung thư, một tế bào bình thường thành tế bào ung thư và một mô cơ quan đang hoạt động bình thường trở thành khối u.
Nhưng quá trình đột biến đó xảy ra như thế nào, thì chỉ có những nhà khoa học nghiên cứu sâu về bệnh ung thư mới hiểu.

Chúng ta biết đột biến gen gây ung thư, nhưng rốt cuộc đột biến đó đã xảy ra như thế nào?
Thông thường, mỗi bệnh ung thư sẽ xuất phát từ một đột biến gen khác nhau. Thế nhưng, có một đột biến mà các nhà khoa học đã tìm thấy nó xuất hiện ở 75% trong tổng số gần 20 triệu ca ung thư được chuẩn đoán mỗi năm trên thế giới.
Đột biến này liên quan đến một protein “ma quái” được ký hiệu là MYC. Trong hàng thập kỷ, các nhà khoa học đã muốn tìm cách ngăn chặn protein này, bởi nếu làm được vậy, họ có thể ngăn chặn được 3/4 số ca ung thư xảy ra liên quan đến nó.
MYC không chỉ liên quan đến quá trình ung thư khởi phát, mà còn thúc đẩy các tế bào ung thư di căn. Do đó, tìm được một loại thuốc đích nhắm đến protein này từ lâu đã là một trong những mục tiêu được săn lùng nhiều nhất trong ngành ung thư học.
Thế nhưng, như đã nói, MYC là một protein “ma quái”. Sự ma quái của nó đã ngăn cản các nhà khoa học tìm được một loại thuốc ngăn chặn nó. Phải sau hàng thập kỷ nỗ lực tìm kiếm, cho đến tận bây giờ, hi vọng mới đang được mở ra, sau một phát hiện của các nhà khoa học đến từ Đại học California, Hoa Kỳ.
Trong đó, họ đã tìm ra một cách hiệu quả để “bắt” MYC, khắc phục sự “ma quái” của nó bằng một phân tử thuốc cũng “quái ma” không kém. Đó là những peptide.
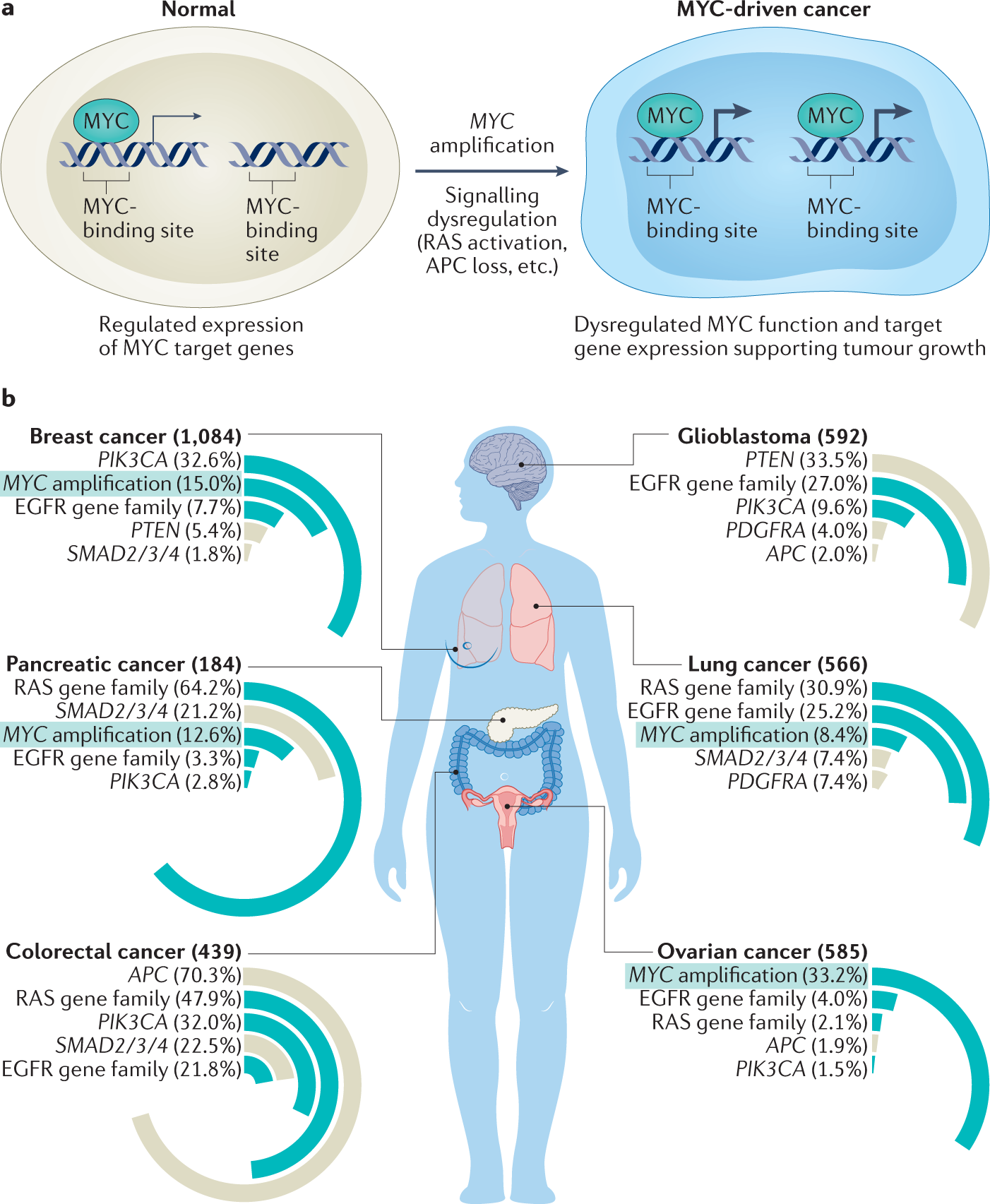
MYC là một đột biến mà các nhà khoa học đã tìm thấy nó xuất hiện ở 75% trong tổng số gần 20 triệu ca ung thư được chuẩn đoán mỗi năm trên thế giới. Trong hình ảnh này (từ trên xuống dưới, từ trái sang phải) là tỷ lệ ung thư mà đột biến MYC góp mặt bao gồm: ung thư vú, ung thư tụy, ung thư đại trực tràng, ung thư não, ung thư phổi và ung thư buồng trứng.
Trước khi chúng ta nói về những peptit có thể trở thành một loại thuốc ung thư phổ thông trong tương lai, hãy nói về sự “ma quái” của MYC. Tại sao các nhà khoa học khó nắm bắt được nó?
MYC là một protein quan trọng tham gia vào quá trình phiên mã của tế bào. Nó giúp chuyển đổi thông tin di truyền từ DNA thành RNA và từ DNA thành protein. Do đó, MYC là một phần không thể thiếu trong quá trình phát triển và phân chia của tế bào.
Thiếu hụt MYC có thể dẫn đến sự chậm lại hoặc ngưng trệ trong quá trình tăng trưởng tế bào cuối cùng ảnh hưởng đến nhiều chức năng trên cơ thể. Nhưng vấn đề cũng có thể xảy ra khi các protein này “nổi loạn”.
“Thông thường, hoạt động của MYC được kiểm soát chặt chẽ. Thế nhưng trong các tế bào ung thư, nó trở nên hoạt động quá mức và không được điều chỉnh hợp lý”, Min Xue, một phó giáo sư tiến sĩ đến từ Đại học California cho biết.
“MYC không phải thức ăn cho tế bào ung thư, nhưng nó giống với một loại thuốc kích thích thúc đẩy sự phát triển nhanh chóng của ung thư. Đó là lý do tại sao MYC được coi là kẻ tội đồ đối với 75% bệnh nhân ung thư trên thế giới”.
Khi một protein gây ra ung thư, điều mà các bác sĩ sẽ nhắm đến là tấn công vào chính protein đó, khi chúng biểu hiện bên trong tế bào ung thư. Tiêu diệt được tế bào chứa protein này chính là chìa khóa để chữa trị căn bệnh, đó cũng là cách mà các loại thuốc đích (nhắm mục tiêu tế bào ung thư) tiên tiến nhất đang sử dụng.
Chẳng hạn, chúng ta có thuốc Trastuzumab (Herceptin) nhắm mục tiêu protein HER2 để điều trị ung thư vú. Crizotinib (Xalkori) nhắm mục tiêu protein ALK để điều trị ung thư phổi. Vemurafenib (Zelboraf) nhắm mục tiêu protein BRAF để điều trị ung thư da.
Thế nhưng bất chấp nhiều thập kỷ nghiên cứu, chúng ta vẫn chưa có bất kỳ loại thuốc nào nhắm mục tiêu được vào MYC. “MYC là một mục tiêu không thể nhắm trúng bằng thuốc và chưa có phương pháp điều trị khả thi về mặt lâm sàng nào“, các nhà nghiên cứu viết.
Nguyên nhân của điều đó là vì MYC khác với các protein khác trong cơ thể, nó không có hình dạng cố định mà bất cứ lúc nào cũng có thể tự biến hóa một cách ma quái. Điều đó khiến MYC không có một điểm bám khả thi nào để phát triển một phân tử thuốc dạng vô cơ hóa học.
Khi các nhà khoa học sử dụng một phân tử thuốc để liên kết vào một vị trí cụ thể trên MYC, protein dạng vòng như những sợi mứt dừa này có thể tự ngọ nguậy để giấu vị trí bị nhắm đến vào trong đám rối của chính nó. Từ đó, phân tử thuốc sẽ mất tác dụng.
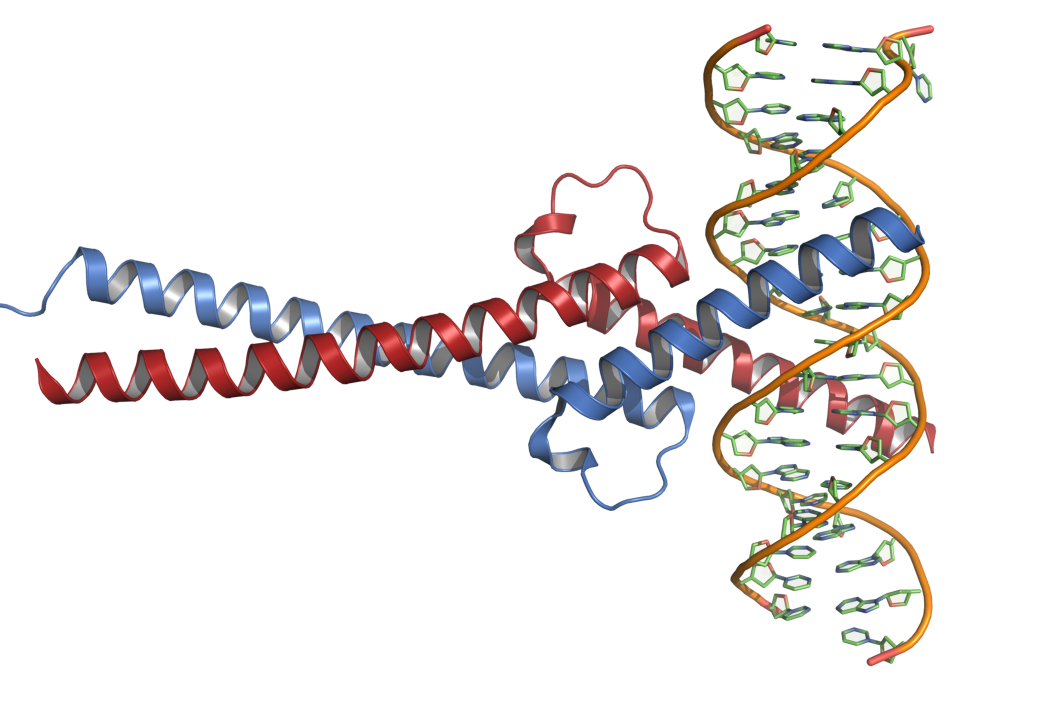
MYC có hình dáng như một sợi mứt dừa. Nó có thể ngọ nguậy để biến hình bất cứ lúc nào. Do đó, thuốc không thể nhắm đích.
“Về cơ bản MYC tồn tại một cách ngẫu nhiên”, phó giáo sư Xue nói. “Các quy trình khám phá thuốc thông thường phải dựa trên các cấu trúc được xác định rõ ràng, điều này thì không tồn tại đối với MYC.”
Hơn nữa, các nhà khoa học cho biết thời gian bán hủy điển hình của MYC rất ngắn, nó có thể tham gia vào quá trình phiên mã và dịch mã của tế bào trong chớp nhoáng. Vì vậy, các phân tử thuốc rất khó nắm bắt được protein này. MYC giống như một “bóng ma” thoắt ẩn thoắt hiện trong tế bào.
Trớ trêu hơn nữa, khu vực hoạt động chính của MYC là tận sâu trong nhân tế bào. Đây có thể được coi là khu vực được bảo vệ nghiêm ngặt nhất của tế bào. Nhân tế bào có một lớp màng chỉ cho các phân tử nhất định đi qua. Vì vậy, nhiều loại thuốc điều trị ung thư, bao gồm các kháng thể, không thể tiếp cận được MYC.
Đây là những lý do khiến protein này nằm ngoài tầm với của các nhà khoa học cho đến hiện tại. Thế nhưng, điều này sẽ sớm thay đổi.
Trong nghiên cứu mới của mình, phó giáo sư Xue và các đồng nghiệp đã tìm ra được một chiến lược tấn công MYC hiệu quả, sử dụng đến peptide thay vì phân tử thuốc hóa học.
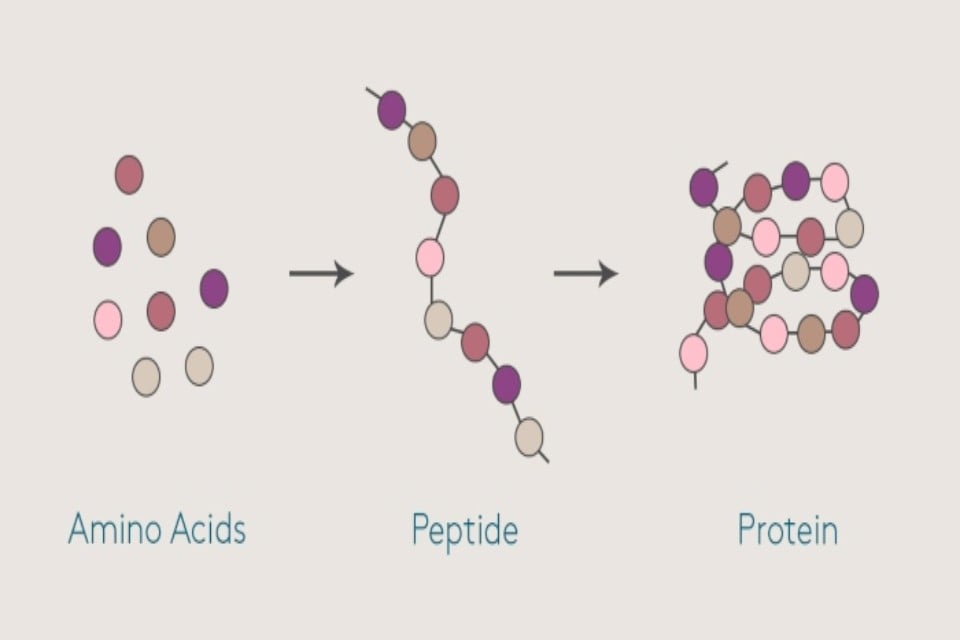
Peptide là một chuỗi ngắn các axit amin liên kết với nhau.
Peptide là một chuỗi ngắn các axit amin liên kết với nhau thông qua liên kết peptid. Có thể hiểu đơn giản, chúng là một protein “mini”, có kích thước nhỏ hơn protein. Peptide có nhiều chức năng trong cơ thể, từ vai trò là hormone, chất dẫn truyền thần kinh, đến khả năng chống vi khuẩn. Chúng tham gia vào quá trình tiêu hóa, sửa chữa mô, và hệ thống miễn dịch.
Các nhà khoa học hiện đang nghiên cứu nhiều loại peptide để thay thế phân tử thuốc hóa học, bởi peptide có thể được hệ thống sinh học của cơ thể chấp nhận dễ dàng hơn. Chúng cũng có thể vượt qua được màng nhân của tế bào và nhắm vào các protein như MYC.
Trong nghiên cứu của mình, phó giáo sư Xue đã sàng lọc một thư viện peptide có khả năng liên kết với các đoạn phân tử trên MYC để tìm ra NT-B2R (C68H100N20O14), một peptide đặc hiệu với nó. Ông nhận thấy khi để NT-B2R gần với MYC, peptide này thể hiện một ái lực rất mạnh với protein đích.
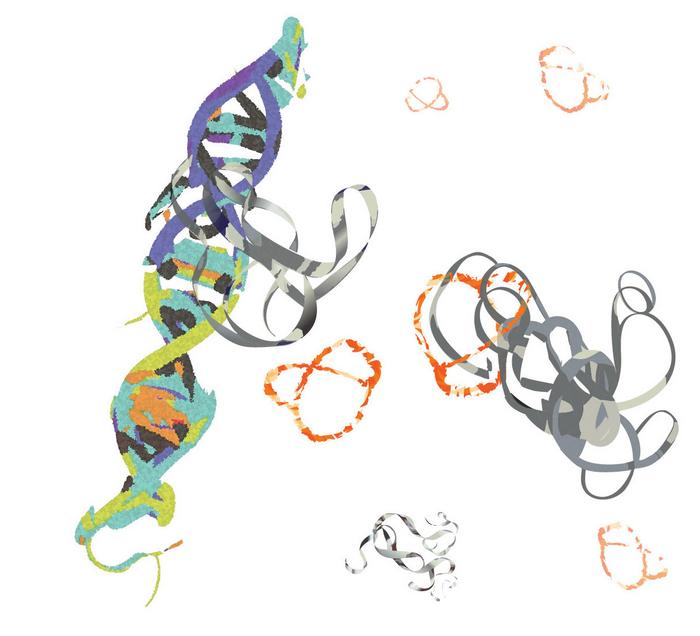
Peptide NT-B2R (màu cam) đang “trói” protein MYC (màu xám) để ngăn chặn các tương tác của nó với DNA (bên trái). Ảnh: UCR.
Điều đặc biệt là bất cứ khi nào MYC thay đổi hình dạng của nó, peptide NT-B2R cũng có thể tự nó biến hình để liên kết với MYC trong hình dạng mới. Khi NT-B2R gắn với MYC, nó dường như có thể vô hiệu hóa hoạt động của protein này.
NT-B2R được ví như một chiếc còng số 8 đối với MYC, mà chỉ cần có mặt nó, MYC sẽ bị khóa chặt, không thể biến hình được nữa. Sau đó thì các nhà khoa học nghĩ họ có thể tìm ra một loại thuốc kết hợp để nhắm vào protein MYC khi nó đã bị trói.
“Các peptide có thể có nhiều dạng, hình dạng và vị trí khác nhau. Nhưng một khi bạn uốn cong và kết nối chúng để tạo thành các vòng, chúng không còn thể có biến hình được nữa, lúc đó chúng có mức độ ngẫu nhiên rất thấp. Điều này giúp ích cho việc liên kết”, phó giáo sư Xue nói.
“Trong nghiên cứu này, chúng tôi đã cải thiện hiệu suất liên kết của peptide so với các phiên bản trước đó gấp hai lần. Điều này khiến nó tiến gần hơn đến mục tiêu phát triển ra một loại thuốc [ung thư nhắm đích MYC]”.

Phó giáo sư Min Xue, nhà hóa sinh đến từ Đại học California, tác giả chính của nghiên cứu. Ảnh: UCR.
Tất nhiên, “khóa tay” được MYC mới chỉ là bước đầu trong việc phát triển một loại thuốc nhắm vào protein này. Các nhà khoa học cho biết họ sẽ còn phải làm nhiều việc trước khi bào chế ra được một loại thuốc điều trị ung thư phổ quát mà 75% bệnh nhân có thể sử dụng nó.
Chẳng hạn, một rào cản nữa phải vượt qua là hiện nhóm của giáo sư Xue đang sử dụng các hạt chất béo dạng nano để đưa NT-B2R vào tế bào, các hạt nano này chưa phải là công cụ lý tưởng để bào chế thuốc.
Thế nhưng, ông hi vọng việc giải được bài toán kéo dài hàng thập kỷ liên quan đến sự “ma quái” của MYC sẽ là một bước tiến quan trọng, mở đường cho nhiều nhóm nghiên cứu khác trên thế giới trở lại cuộc đua tìm kiếm thuốc nhắm đích protein MYC.
“Trước đây MYC là một ví dụ điển hình cho sự vô định vì protein này không hề có cấu trúc cố định. Nhưng bản thân nó lại trực tiếp góp phần gây ra rất nhiều loại ung thư, khiến MYC từ lâu đã trở thành một mục tiêu để phát triển thuốc đích. Thật vui mừng vì bây giờ đây, chúng ta cuối cùng cũng đã bắt được protein này”, phó giáo sư Xue nói.
Nguồn: Sciencealert, UCR, ACS, Nature
Nguồn tin: https://genk.vn/nguyen-nhan-ma-quai-gay-ra-3-4-tong-so-ca-ung-thu-tren-toan-the-gioi-20240209203538801.chn



